On se propose d’étudier la cinétique de la transformation lente de décomposition de l’eau oxygénée par les ions iodure en présence d’acide sulfurique, transformation considérée comme totale.
L’équation de la réaction qui modélise la transformation d’oxydoréduction s’écrit :H2O2 (aq) + 2 I–(aq) + 2 H3O+(aq) = I2 (aq) + 4 H2O(l)
Identifier les couples oxydant/réducteur mis en jeu lors de cette transformation.- I–(aq)/I2 (aq) et H2O2 (aq)/H2O(l)
- H2O2 (aq)/H2O(l) et I2 (aq)/I–(aq)
- H3O+/H2O(l) et H2O2 (aq)/H2O(l)
- I2 (aq)/I–(aq) et H3O+/H2O(l)
Sachant que l'équation de la réaction qui modélise la transformation d’oxydoréduction s’écrit :
H2O2 (aq) + 2 I–(aq) + 2 H3O+(aq) = I2 (aq) + 4 H2O(l).
Choisir la proposition correcte.- H2O2 (aq) est l'oxydant et I–(aq) est le réducteur. Au cours de la transformation le réducteur accepte les électrons cédés par l'oxydant.
- I–(aq) est l'oxydant et H2O2 (aq)est le réducteur. Au cours de la transformation le réducteur accepte les électrons cédés par l'oxydant.
- I–(aq) est l'oxydant et H2O2 (aq)est le réducteur. Au cours de la transformation l'oxydant accepte les électrons cédés par le réducteur.
- H2O2 (aq) est l'oxydant et I–(aq) est le réducteur. Au cours de la transformation l'oxydant accepte les électrons cédés par le réducteur.
On mélange une solution d'eau oxygénée et une solution acidifiée d'iodure de potassium. On schématise ce mélange lors de son évolution.
Quelle est l'espèce chimique responsable de la coloration du mélange ?- H2O2 (aq)
- H3O+
- I–(aq)
- I2 (aq)
On a réalisé 4 schémas du mélange réalisé à la question précédente.
Classer ces schémas du plus proche au plus éloigné de l'instant où l'on a réalisé le mélange.- schéma1, schéma 3, schéma 4, schéma 2
- schéma 4, schéma 3, schéma 1, schéma 2
- schéma 3, schéma 1, schéma 4, schéma 2
- schéma 2, schéma 3, schéma 4, schéma 1
Pourquoi peut-on suivre l'évolution de ce système chimique en utilisant un spectrophotomètre ou un colorimètre ?
- Lors de la transformation des ions sont consommés
- Le mélange réactionnel est coloré.
- Le mélange est incolore.
- Le mélange réactionnel est coloré et sa couleur évolue au cours du temps.
Pour réaliser le suivi temporel de cette transformation, on dispose du colorimètre photographié ci-dessous.

- 470 nm
- 655 nm
- 585 nm
- 565 nm
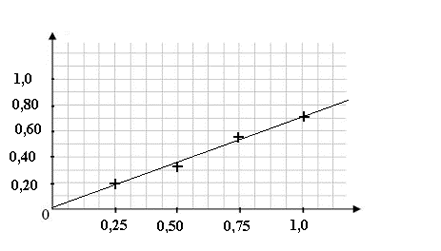
Une fois la longueur d'onde réglée, on réalise l'étalonnage du colorimètre. On mesure l'absorbance de solutions de diiode de concentration connue.
[I2] (mol.L-1)2,5.10-45,0.10-47,5.10-41,0.10-3A0,190,330,530,70
On trace la courbe qui représente l'évolution de l'absorbance en fonction de la concentration en diiode. Quelle est la courbe correcte ?-
En utilisant la courbe qui représente l'aborbance en fonction de la concentration en diiode, trouver la relation numérique qui lie l'absorbance à la concentration en diiode de la solution.
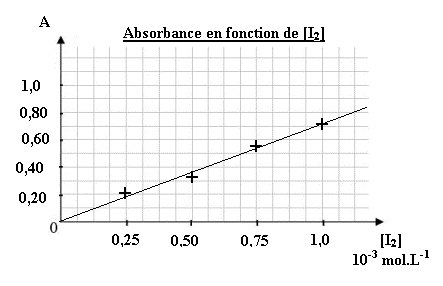
- A = 0,70.[I2]
- A = 1,4.10-3.[I2]
- A = 7,0.102.[I2] + 0,10
- A = 7,0.102.[I2]
On mélange 5 mL d'une solution d'eau oxygénée de concentration 1,0.10-2 mol.L-1 et 40 mL d'une solution d'iodure de potassium de concentration 3,5.10-2 mol.L-1. Comment l'absorbance de la solution variera-t-elle au cours du temps ?
- L'absorbance augmente puis se stabilise lorsque la transformation est terminée.
- L'absorbance diminue
- L'absorbance est constante
- L'absorbance augmente puis diminue.
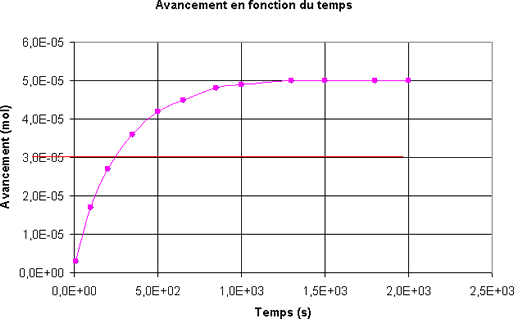
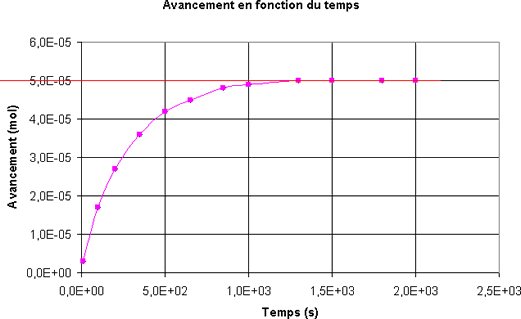
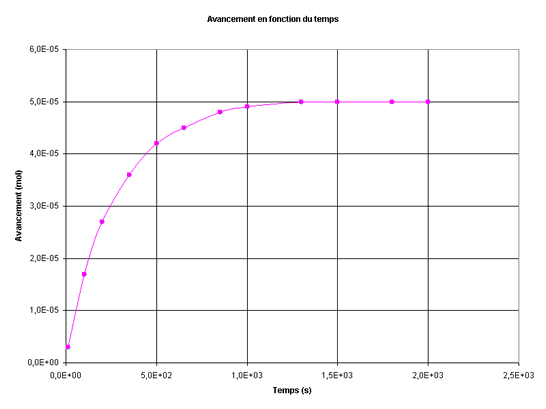
On trace la courbe qui représente l'évolution de l'absorbance au cours du temps.
Quelle est la concentration en diiode du mélange à l'instant t = 500 s ? On rappelle que dans les conditions de l'expérience A = 700.[I2].- A l'instant t = 500 s, [I2] = 8,9.10-4 mol.L-1
- A l'instant t = 500 s, [I2] = 0,62 mol.L-1
- A l'instant t = 500 s, [I2] = 1,0.10-3 mol.L-1
- A l'instant t = 500 s, [I2] = 1,1.103 mol.L-1
Quelle est la quantité de diiode présente dans le mélange à l'instant t = 500 s ? On rappelle que le volume du mélange est VT = 45 mL et que à l'instant t = 500 s, [I2] = 8,9.10-4 mol.L-1.
- A l'instant t = 500 s; la quantité de diiode présente dans le mélange est n(I2) = 4,0.10-2 mol
- A l'instant t = 500 s; la quantité de diiode présente dans le mélange est n(I2) = 4,0.10-5mol.L-1
- A l'instant t = 500 s; la quantité de diiode présente dans le mélange est n(I2) = 4,0.10-5 mol
- A l'instant t = 500 s; la quantité de diiode présente dans le mélange est n(I2) = 2,0.10-2 mol
Quelle est la relation qui lie la quantité de diiode n(I2) à un instant donné à l'avancement x de la réaction au même instant ? On pourra réaliser un tableau descriptif de l'évolution du système utilisant l'avancement. On rappelle que l'équation de la réaction est
H2O2 (aq) + 2 I–(aq) + 2 H3O+(aq) = I2 (aq) + 4 H2O(l) - n(I2) = 2.x
- n(I2) = x/2
- n(I2) = x
- n(I2) = n0(I2) - 2.x avec n0(I2) la quantité de diiode présente à l'instant t = 0 s.
Quel est l'avancement x de la réaction à la date t = 500 s ?
- A l'instant t = 500 s; l'avancement de la réaction est
x = 4,0.10-5 mol.L-1 - A l'instant t = 500 s; l'avancement de la réaction est
x = 8,0.10-5 mol - A l'instant t = 500 s; l'avancement de la réaction est
x = 2,0.10-5 mol - A l'instant t = 500 s; l'avancement de la réaction est
x = 4,0.10-5 mol
- A l'instant t = 500 s; l'avancement de la réaction est
Quelle est la relation qui lie l'avancement de la réaction x à un instant t donné et l'absorbance A de la solution au même instant ? k est le coefficient de proportionnalité liant l'absorbance à la concentration en diiode de la solution et VT est le volume total du mélange.
-
Choisir la définition correcte du temps de demi-réaction
- Le temps de demi-réaction est égal à la moitié de l'avancement final.
- Le temps de demi-réaction est la durée au bout de laquelle l'avancement a atteint la moitié de l'avancement final.
- Le temps de demi-réaction est égal à la moitié de la durée totale de la transformation.
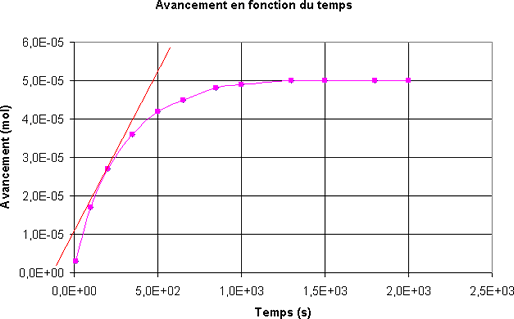
Pour le mélange étudié, quel est le temps de demi-réaction ?
- t1/2 = 1000 s
- t1/2 = xf/2 = 2,5.10-5 mol
- t1/2 = 200 s
- t1/2 = 400 s
On réalise les trois mélanges suivants :
mélange 1 : 5 mL d'une solution d'eau oxygénée de concentration 1,0.10-2 mol.L-1 et 40 mL d'une solution acidifiée d'iodure de potassium de concentration 3,5.10-2 mol.L-1;
mélange 2 : 5 mL d'une solution d'eau oxygénée de concentration 1,0.10-2 mol.L-1 et 40 mL d'une solution acidifiée d'iodure de potassium de concentration 1,8.10-2 mol.L-1;
mélange 3 : 5 mL d'une solution d'eau oxygénée de concentration 1,0.10-2 mol.L-1 et 40 mL d'une solution acidifiée d'iodure de potassium de concentration 9,0.10-3 mol.L-1.
On réalise la courbe qui représente l'évolution de l'avancement au cours du temps pour le mélange 1, pour le mélange 2 et pour le mélange 3 sur le même graphe.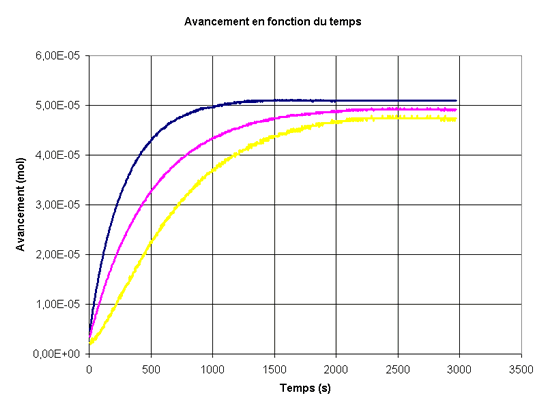
-
Mélange 1 : t1/2 = 200 s;
mélange 2 : t1/2 = 460 s;
mélange 3 : t1/2 = 340 s. -
Mélange 1 : t1/2 = 460 s;
mélange 2 : t1/2 = 340 s;
mélange 3 : t1/2 = 200 s. -
Mélange 1 : t1/2 = 340 s;
mélange 2 : t1/2 = 200 s;
mélange 3 : t1/2 = 460 s. -
Mélange 1 : t1/2 = 200 s;
mélange 2 : t1/2 = 340 s;
mélange 3 : t1/2 = 460 s.
-
Choisir la définition correcte de la vitesse volumique de la réaction à la date t = 500 s. On note v la vitesse volumique de réaction et VT le volume du mélange.
-
La vitesse volumique v à un instant t s'écrit :
.
Quelle est l'unité (dans le système international d'unité) de la vitesse volumique d'une réaction ?- mol.s.L-1
- mol.L.s-1
- L.s.mol-1
- mol.L-1.s-1
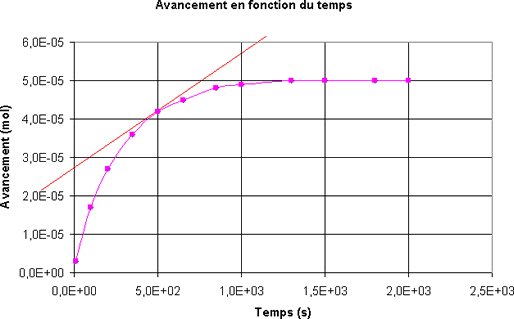
Quel est le tracé qui permet de déterminer la dérivée de l'avancement par rapport au temps à l'instant t = 500 s ?
-
On représente l'évolution de l'avancement au cours du temps.

Quelle est la vitesse volumique de la réaction à l'instant t = 500 s ?
Le volume du mélange est VT = 45 mL- A l'instant t = 500 s, la vitesse volumique de la réaction est v = 1,3.10-9 mol.L-1.s-1.
- A l'instant t = 500 s, la vitesse volumique de la réaction est v = 8,0.108 mol.L-1.s-1.
- A l'instant t = 500 s, la vitesse volumique de la réaction est v = 1,3.10-7 mol.L-1.s-1.
- A l'instant t = 500 s, la vitesse volumique de la réaction est v = 6,2.10-7 mol.L-1.s-1.
Comment évolue la vitesse volumique v de la réaction au cours du temps ?

- v diminue au cours du temps.
- v est constante au cours du temps.
- v augmente au cours du temps.
Pourquoi la vitesse volumique de la réaction diminue-t-elle au cours de la transformation ?
- Les concentrations des réactifs diminuent au cours de la transformation.
- La concentration en diiode diminue au cours de la transformation.
- Il y a formation d'eau lors de cette transformation.
- La concentration en diiode augmente au cours du temps.
On a pour trois mélanges différents représenté l'évolution de l'avancement au cours du temps. Les trois courbes ont été tracées sur le même graphe. Les trois mélanges ont le même volume.
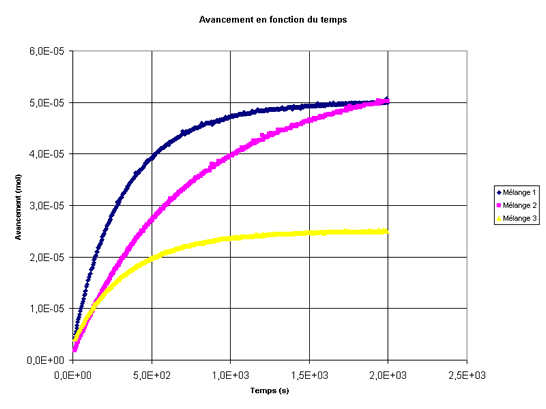
Choisir la proposition juste.- A l'instant t = 1500 s, la vitesse volumique de la réaction est plus grande pour le mélange 1 que pour le mélange 2.
- A l'instant t = 0 s, la vitesse volumique de la réaction est plus grande pour le mélange 1 que pour les mélanges 2 et 3.
- A l'instant t = 0 s, la vitesse volumique de la réaction est plus grande pour le mélange 2 que pour les mélanges 1 et 3.
- A l'instant t = 500 s, la vitesse volumique de la réaction est plus grande pour le mélange 1 que pour le mélange 2.
On réalise le même mélange en augmentant la température du mélange. On superpose la nouvelle courbe (courbe rose) représentant l'avancement au cours du temps sur celle obtenue pour le mélange précédent (courbe bleue). Identifier le graphe correct.
-
On réalise les trois mélanges suivants :
mélange 1 : 5 mL d'une solution d'eau oxygénée de concentration 1,0.10-2 mol.L-1 et 40 mL d'une solution acidifiée d'iodure de potassium de concentration 3,5.10-2 mol.L-1;
mélange 2 : 5 mL d'une solution d'eau oxygénée de concentration 1,0.10-2 mol.L-1 et 40 mL d'une solution acidifiée d'iodure de potassium de concentration 1,8.10-2 mol.L-1;
mélange 3 : 5 mL d'une solution d'eau oxygénée de concentration 1,0.10-2 mol.L-1 et 40 mL d'une solution acidifiée d'iodure de potassium de concentration 9,0.10-3 mol.L-1.
On réalise les courbes qui représentent l'évolution de l'avancement au cours du temps pour le mélange 1, pour le mélange 2 et pour le mélange 3 sur le même graphe.
Choisir l'association correcte.-
Mélange 1 : courbe bleue
Mélange 2 : courbe rose
Mélange 3 : courbe jaune -
Mélange 1 : courbe bleue
Mélange 2 : courbe jaune
Mélange 3 : courbe rose -
Mélange 1 : courbe rose
Mélange 2 : courbe bleue
Mélange 3 : courbe jaune -
Mélange 1 : courbe rose
Mélange 2 : courbe jaune
Mélange 3 : courbe bleue
-
On réalise les deux mélanges suivants :
Mélange 1 : 20,0 mL d’une solution d’iodure de potassium de concentration 0,070 mol.L-1 ; 5,0 mL d’eau oxygénée de concentration 0,010 mol.L-1 ; 20,0 mL d’une solution d’acide sulfurique de concentration 1,0 mol.L-1.
Mélange 2 : 20,0 mL d’une solution d’iodure de potassium de concentration 0,070 mol.L-1; 5,0 mL d’eau oxygénée de concentration 0,0050 mol.L-1 ; 20,0 mL d’une solution d’acide sulfurique de concentration 1,0 mol.L-1.
L’équation de la réaction qui modélise la transformation d’oxydoréduction s’écrit :H2O2 (aq) + 2 I–(aq) + 2 H3O+(aq) = I2 (aq) + 4 H2O(l)
Lorsque la transformation est terminée dans les deux bechers, on prend une photo de chaque mélange. Choisir le jeu de photos correct.-
On réalise les deux mélanges suivants :
Mélange 1 : 20,0 mL d’une solution d’iodure de potassium de concentration 0,070 mol.L-1 ; 5,0 mL d’eau oxygénée de concentration 0,010 mol.L-1 ; 20,0 mL d’une solution d’acide sulfurique de concentration 1,0 mol.L-1.
Mélange 2 : 20,0 mL d’une solution d’iodure de potassium de concentration 0,035 mol.L-1 ; 5,0 mL d’eau oxygénée de concentration 0,010 mol.L-1 ; 20,0 mL d’une solution d’acide sulfurique de concentration 1,0 mol.L-1.
L’équation de la réaction qui modélise la transformation d’oxydoréduction s’écrit :H2O2 (aq) + 2 I–(aq) + 2 H3O+(aq) = I2 (aq) + 4 H2O(l)
Lorsque la transformation est terminée dans les deux bechers, on prend une photo de chaque mélange. Choisir le jeu de photos correct.-
Sur le même graphe, on a tracé la courbe représentant l'évolution de l'avancement au cours du temps pour les trois mélanges suivants :
Mélange 1 : 20,0 mL d’une solution d’iodure de potassium de concentration 0,070 mol.L-1 ; 5,0 mL d’eau oxygénée de concentration 0,010 mol.L-1 ; 20,0 mL d’une solution d’acide sulfurique de concentration 1,0 mol.L-1.
Mélange 2 : 20,0 mL d’une solution d’iodure de potassium de concentration 0,035 mol.L-1 ; 5,0 mL d’eau oxygénée de concentration 0,010 mol.L-1 ; 20,0 mL d’une solution d’acide sulfurique de concentration 1,0 mol.L-1.
Mélange 3 : 20,0 mL d’une solution d’iodure de potassium de concentration 0,070 mol.L-1; 5,0 mL d’eau oxygénée de concentration 0,0050 mol.L-1 ; 20,0 mL d’une solution d’acide sulfurique de concentration 1,0 mol.L-1.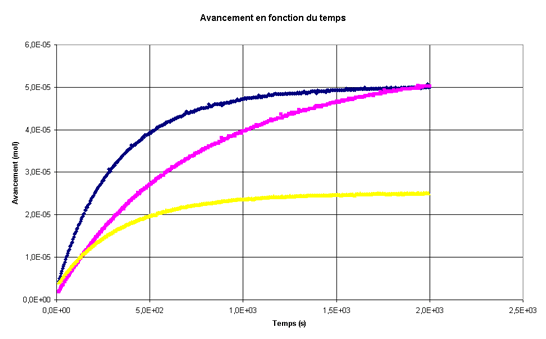
L’équation de la réaction qui modélise la transformation d’oxydoréduction s’écrit :H2O2 (aq) + 2 I–(aq) + 2 H3O+(aq) = I2 (aq) + 4 H2O(l)
Associer chacune des courbes à son mélange.-
Mélange 1 : courbe bleue
Mélange 2 : courbe rose
Mélange 3 : courbe jaune -
Mélange 1 : courbe bleue
Mélange 2 : courbe jaune
Mélange 3 : courbe rose -
Mélange 1 : courbe rose
Mélange 2 : courbe jaune
Mélange 3 : courbe bleue -
Mélange 1 : courbe rose
Mélange 2 : courbe bleue
Mélange 3 : courbe jaune
-